Densidad
| Sustancia | Densidad media (en kg/m3) |
|---|---|
| Aceite | 920 |
| Acero | 7850 |
| Agua destilada a 4 °C | 1000 |
| Agua de mar | 1027 |
| Aire | 1,2 |
| Aerogel | 1-2 |
| Alcohol | 780 |
| Magnesio | 1740 |
| Aluminio | 2700 |
| Carbono | 2260 |
| Caucho | 950 |
| Cobre | 8960 |
| Cuerpo humano | 950 |
| Diamante | 1320 |
| Gasolina | 680 |
| Helio | 0,18 |
| Hielo | 980 |
| Hierro | 7874 |
| Hormigón armado | 2400-2500 |
| Madera | 600 - 900 |
| Mercurio | 13580 |
| Oro | 19300 |
| Wolframio | 19250 |
| Uranio | 19050 |
| Tántalo | 16650 |
| Torio | 11724 |
| Estaño | 7310 |
| Piedra pómez | 700 |
| Plata | 10490 |
| Osmio | 22610 |
| Iridio | 22560 |
| Platino | 21450 |
| Plomo | 11340 |
| Poliuretano | 40 |
| Sangre | 1060 - 1088 |
| Tierra (planeta) | 5515 |
| Vidrio | 2500 |
Ejemplo: un objeto pequeño y pesado, como una piedra de granito o un trozo de plomo, es más denso que un objeto grande y liviano hecho de corcho o de espuma de poliuretano.
Historia
Según un cuento conocido, a Arquímedes le dieron la tarea de determinar si el orfebre de Hierón II de Siracusa desfalcaba el oro durante la fabricación de una corona dedicada a los dioses, y si además lo sustituía por otro metal más barato (proceso conocido como aleación).[1]Arquímedes sabía que la corona, de forma irregular, podría ser aplastada o fundida en un cubo cuyo volumen se puede calcular fácilmente comparado con la masa. Pero el rey no estaba de acuerdo con estos métodos, pues habrían supuesto la destrucción de la corona.
Desconcertado, Arquímedes se dio un relajante baño de inmersión, y observando la subida del agua caliente cuando él entraba en ella, descubrió que podía calcular el volumen de la corona de oro mediante el desplazamiento del agua. Supuestamente, al hacer este descubrimiento salió corriendo desnudo por las calles gritando: "¡Eureka! ¡Eureka!" (Εύρηκα! en griego, que significa: "Lo encontré"). Como resultado, el término "Eureka" entró en el lenguaje común, y se utiliza hoy para indicar un momento de iluminación.
La historia apareció por primera vez en forma escrita en De Architectura de Vitrubio, dos siglos después de que supuestamente tuviese lugar.[2] Sin embargo, algunos estudiosos han dudado de la veracidad de este relato, diciendo (entre otras cosas) que el método habría exigido medidas exactas que habrían sido difíciles de hacer en ese momento.[3] [4]
Densidad
La densidad o densidad absoluta es la magnitud que expresa la relación entre la masa y el volumen de un cuerpo. Su unidad en el Sistema Internacional es el kilogramo por metro cúbico (kg/m3), aunque frecuentemente se expresa en g/cm3. La densidad es una magnitud intensivadonde ρ es la densidad, m es la masa y V es el volumen del determinado cuerpo.
Densidad relativa
La densidad relativa de una sustancia es la relación existente entre su densidad y la de otra sustancia de referencia; en consecuencia, es una magnitud adimensional (sin unidades)donde ρr es la densidad relativa, ρ es la densidad de la sustancia, y ρ0 es la densidad de referencia o absoluta.
Para los líquidos y los sólidos, la densidad de referencia habitual es la del agua líquida a la presión de 1 atm y la temperatura de 4 °C. En esas condiciones, la densidad absoluta del agua destilada es de 1000 kg/m3, es decir, 1 kg/L.
Para los gases, la densidad de referencia habitual es la del aire a la presión de 1 atm y la temperatura de 0 °C.
Unidades de densidad
Unidades de densidad en el Sistema Internacional de Unidades (SI):- kilogramo por metro cúbico (kg/m³).
- gramo por centímetro cúbico (g/cm³).
- kilogramo por litro (kg/L) o kilogramo por decímetro cúbico. El agua tiene una densidad próxima a 1 kg/L (1000 g/dm³ = 1 g/cm³ = 1 g/mL).
- gramo por mililitro (g/mL), que equivale a (g/cm³).
- Para los gases suele usarse el gramo por decímetro cúbico (g/dm³) o gramo por litro (g/L), con la finalidad de simplificar con la constante universal de los gases ideales:
Unidades usadas en el Sistema Anglosajón de Unidades:
- onza por pulgada cúbica (oz/in3)
- libra por pulgada cúbica (lb/in3)
- libra por pie cúbico (lb/ft3)
- libra por yarda cúbica (lb/yd3)
- libra por galón (lb/gal)
- libra por bushel americano (lb/bu)
- slug por pie cúbico.
Densidad media y puntual
Para un sistema homogéneo, la fórmula masa/volumen puede aplicarse en cualquier región del sistema obteniendo siempre el mismo resultado.Sin embargo, un sistema heterogéneo no presenta la misma densidad en partes diferentes. En este caso, hay que medir la "densidad media", dividiendo la masa del objeto por su volumen o la "densidad puntual" que será distinta en cada punto, posición o porción infinitesimal del sistema, y que vendrá definida por:
Densidad aparente y densidad real
La densidad aparente es una magnitud aplicada en materiales porosos como el suelo, los cuales forman cuerpos heterogéneos con intersticios de aire u otra sustancia normalmente más ligera, de forma que la densidad total del cuerpo es menor que la densidad del material poroso si se compactase.En el caso de un material mezclado con aire se tiene:
La densidad aparente de un material no es una propiedad intrínseca del material y depende de su compactación.
La Densidad aparente del suelo (Da) se obtiene secando una muestra de suelo de un volumen conocido a 105 °C hasta peso constante.

Donde:
- WSS: Peso de suelo secado a 105 °C hasta peso constante.
- VS: Volumen original de la muestra de suelo.
Medición de densidad
La densidad puede obtenerse de forma indirecta y de forma directa. Para la obtención indirecta de la densidad, se miden la masa y el volumen por separado y posteriormente se calcula la densidad. La masa se mide habitualmente con una balanza, mientras que el volumen puede medirse determinando la forma del objeto y midiendo las dimensiones apropiadas o mediante el desplazamiento de un líquido, entre otros métodos.Entre los instrumentos más comunes para la medida de densidades tenemos:
- El densímetro, que permite la medida directa de la densidad de un líquido
- El picnómetro, que permite la medida precisa de la densidad de sólidos, líquidos y gases (picnómetro de gas).
- La balanza hidrostática, que permite calcular densidades de sólidos.
- La balanza de Mohr (variante de balanza hidrostática), que permite la medida precisa de la densidad de líquidos.
Cambios de densidad
En general, la densidad de una sustancia varía cuando cambia la presión o la temperatura.- Cuando aumenta la presión, la densidad de cualquier material estable también aumenta.
- Como regla general, al aumentar la temperatura, la densidad disminuye (si la presión permanece constante). Sin embargo, existen notables excepciones a esta regla. Por ejemplo, la densidad del agua crece entre el punto de fusión (a 0 °C) y los 4 °C; algo similar ocurre con el silicio a bajas temperaturas.[cita requerida]
Por otro lado, la densidad de los gases es fuertemente afectada por la presión y la temperatura. La ley de los gases ideales describe matemáticamente la relación entre estas tres magnitudes:
donde
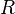 es la constante universal de los gases ideales,
es la constante universal de los gases ideales,  es la presión del gas,
es la presión del gas,  su masa molar y
su masa molar y 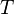 la temperatura absoluta.
la temperatura absoluta.Eso significa que un gas ideal a 300 K (27 °C) y 1 atm duplicará su densidad si se aumenta la presión a 2 atm manteniendo la temperatura constante o, alternativamente, se reduce su temperatura a 150 K manteniendo la presión constante.
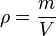
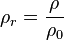


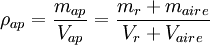

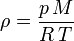
No hay comentarios:
Publicar un comentario