Reactivo limitante
Cuando una ecuación está balanceada, la estequiometría se emplea para saber los moles de un producto obtenidos a partir de un número conocido de moles de un reactivo. La relación de moles entre reactivo y producto se obtiene de la ecuación balanceada.
Generalmente cuando se efectúa una reacción química los reactivos no se encuentran en cantidades estequiométricas exactas, es decir, en las proporciones que indica su ecuación balanceada. En consecuencia, algunos reactivos se consumen totalmente, mientras que otros son recuperados al finalizar la reacción. El reactivo que se consume en primer lugar es llamado reactivo limitante, ya que la cantidad de éste determina la cantidad total de producto formado. Cuando este reactivo se consume, la reacción se detiene. El o los reactivos que se consumen parcialmente son los reactivos en exceso.
La cantidad de producto que se obtiene cuando reacciona todo el reactivo limitante se denomina rendimiento teórico de la reacción.
El concepto de reactivo limitante permite a los químicos asegurarse de que un reactivo, el más costoso, sea completamente consumido en el transcurso de una reacción, aprovechándose así al máximo.
Método 1
Este método se basa en la comparación de la proporción de cantidades de reactivo con la relación estequiométrica. Así, dada la ecuación general:Si
 <
<  entonces X es el reactivo limitante.
entonces X es el reactivo limitante.Si
 >
>  entonces Y es el reactivo limitante.
entonces Y es el reactivo limitante.Ejemplo
La ecuación balanceada para la oxidación del monóxido de carbono a dióxido de carbono es la siguiente:Aplicando el procedimiento anterior tenemos que
 <
<  , por lo tanto CO es el reactivo limitante. En efecto, cuatro moles de CO sólo necesitan dos moles de O2 para reaccionar, por lo que un mol de O2 quedará como exceso una vez finalizada la reacción.
, por lo tanto CO es el reactivo limitante. En efecto, cuatro moles de CO sólo necesitan dos moles de O2 para reaccionar, por lo que un mol de O2 quedará como exceso una vez finalizada la reacción.Este procedimiento puede hacerse extensivo a reacciones químicas con más de dos reactivos aplicando la fórmula:
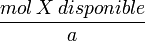
para todos los reactivos. El reactivo con el cociente más bajo es el reactivo limitante.
Método 2
Este método consiste en el cálculo de la cantidad esperada de producto en función de cada reactivo.Se permite que reaccionen 3g de dióxido de silicio y 4,5g de carbono a altas temperaturas, para dar lugar a la formación de carburo de silicio según la ecuación:
Rendimiento químico

Uno o más reactivos en una reacción química suelen ser usados en exceso. El rendimiento teórico es calculado basado en la cantidad molar del reactivo limitante, tomando en cuenta la estequiometría de la reacción. Para el cálculo, se suele asumir que hay una sola reacción involucrada.
El rendimiento teórico o ideal de una reacción química debería ser el 100%, un valor que es imposible alcanzar en la mayoría de puestas experimentales. De acuerdo con Vogel, los rendimientos cercanos al 100% son denominados cuantitativos, los rendimientos sobre el 90% son denominados excelentes, los rendimientos sobre el 80% muy buenos, sobre el 70% son buenos, alrededor del 50% son regulares, y debajo del 40% son pobres.[1] Los rendimientos parecen ser superiores al 100% cuando los productos son impuros. Los pasos de purificación siempre disminuyen el rendimiento, y los rendimientos reportados usualmente se refieren al rendimiento del producto final purificado





Gracias
ResponderEliminar